Sản xuất H2SO4 theo sơ đồ sau :
\(S\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
Tính khối lượng quặng lưu huỳnh chứa 60% lưu huỳnh để sản xuất 2 tấn H2SO4 . Biết hiệu suất đạt 80%
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric. Tính khối lượng dung dịch H 2 SO 4 50% thu được từ 73,5 tấn H 2 SO 4 đã được sản xuất ở trên.
Khối lượng dung dịch H 2 SO 4 50% thu được :
100 tấn dung dịch có 50 tấn H 2 SO 4
x tấn ← 73,5 tấn
x = 73,5x100/50 = 147 tấn
a) Viết các phương trình hóa học điều chế H2SO4 từ quặng pirit sắt FeS2 theo sơ đồ chuyển hóa sau:
\(FeS_2\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
b) Từ 1,2 tấn quặng có chứa 90% FeS2 ( về khối lượng ),có thể sản xuất được bao nhiêu tấn H2SO4 96% ?.Biết rằng hiệu suất của quá trình sản xuất là 85%.
P/s: Giúp mình câu b thôi,dùng phương pháp bảo toàn nguyên tố nha.|Trong sách họ giải quá ngắn=>ko hiểu.
a) 4FeS2 + 11O2 ––> 2Fe2O3 + 8SO2
2SO2 + O2 -----(tº)------> 2SO3
SO3 + H2O ––> H2SO4
Trên thực tế, SO3 cũng bị hấp thụ bởi H2SO4 để tạo ra ôleum (H2S2O7), chất này sau đó bị làm loãng để tạo thành axít sulfuric.
H2SO4 + SO3 → H2S2O7
Ôleum sau đó phản ứng với nước để tạo H2SO4 đậm đặc.
H2S2O7+ H2O → 2 H2SO4
b) 1.2 tấn= 1200000g
mFeS2= 1200000*90%=1080000g
=>nFeS2=1080000/120=9000 mol
Ta có sơ đồ : FeS2 ---> 2SO2 -->2SO3 --> 2H2SO4
9000 mol 18000 mol
Theo định luật bảo toàn nguyên tố:
nH2SO4= 18000*85%=15300 mol
=>mH2SO4= 15300*98= 1499400g
Theo đề C%= 96%
=>mddH2SO4=1499400*100/96=1561875g=1.561875 tấn
Số khủng khiếp quá, bạn xem lại giúp tôi nhé. tôi tính hơi nhanh :)
Tính khối lượng quặng lưu huỳnh cần dùng để sản xuất 3,52 kg sắt 2 sunfua biết hiệu suất đạt 90% và quặng chứa 10% tạp chất
Fe + S (0,04 mol) \(\underrightarrow{t^o}\) FeS (0,04 mol).
Số mol sắt (II) sunfua cần sản xuất là 3,52/88=0,04 (mol).
Khối lượng lưu huỳnh cần dùng trên lý thuyết là 0,04.32=1,28 (g).
Khối lượng quặng lưu huỳnh thực tế cần dùng là 1,28:90%:90%=128/81 (g).
Từ 1 tấn quặng Lưu huỳnh có 2% tạp chất cho người ta có thể sản xuất bao nhiêu tấn dung dịch h2so4 98% với hiệu suất chung của quá trình sản suất là 80%
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric. Tính hiệu suất của quá trình sản xuất axit sunfuric.
Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%
cho sơ đồ 3 phản ứng sau:
\(FeS_2\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
a, viết pthh của các phản ứng biêu diễn sơ đồ trên (ghi rõ đk)
b,tính khối lượng \(FeS_2\)cần để điều chế 50g dd\(H_2SO_4\) \(49\%\)
c, nếu hấp thụ toàn bộ lhis \(SO_2\) tạo thành từ phản ứng (1) bằng 300ml dd \(NaOH\) \(1M\) thì khối lượng muối tạo thành sau phản ứng là bao nhiêu?
a)\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
\(2SO_2+O_2\underrightarrow{t^o}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
b)\(m_{H_2SO_4}=\dfrac{50\cdot49\%}{100\%}=24,5g\Rightarrow n_{H_2SO_4}=0,25mol\)
Từ quá trình trên: \(4FeS_2\rightarrow H_2SO_4\)
\(\Rightarrow n_{FeS_2}=\dfrac{1}{4}n_{H_2SO_4}=\dfrac{1}{4}\cdot0,25=\dfrac{1}{16}mol\)\
\(m_{FeS_2}=\dfrac{1}{16}\cdot120=7,5g\)
c)\(n_{NaOH}=0,3\cdot1=0,3mol\)
\(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
0,15 0,3 0,15
\(m_{Na_2SO_3}=0,15\cdot126=18,9g\)
Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4 . Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là:
A. 40%
B. 60%
C. 80%
D. 62,5%
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là:
A. 40%.
B. 60%.
C. 80%.
D. 62,5%
Đáp án C.
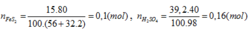
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Từ 40 tấn quặng Pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric.
a) Tính hiệu suất của quá trình sản xuất axit sunfuric.
b) Tính khối lượng của dd axit sunfuric 50% thu được từ 73,5 tấn H2SO4 đã được sản xuất ở trên 

Đề có phải là : ' Từ 80 tấn quặng Pirit chứa 40% lưu huỳnh , người ta sản xuất được 73,5 tấn axit sunfuric . '' đúng không
không phải